
|
التحليل اعتماداً على طريقة الاستشراب السائل بالضغط العالي HPLC |

يوفر الاستشراب السائل بالضغط العالي
HPLC طريقة نموذجية لدراسة العديد من المعالم الكيميائية الحيوية.
وخلافاً للطرائق الأخرى، فإن هذه الطريقة تسمح بتقييم العديد من المواد
المحللة بجريان مفرد .single run
إن الدقة اللامتناهية التي تتمتع بها طريقة الـ HPLC تزودنا بقياسات
كمية ونصف كمية دقيقة للغاية.
الأمراض الوعائية Vascular Diseases
. الفيتامين B6
.
الهوموسستئين (فرط الهوموسستيئينية- التصلب العصيدي)
.
التنميط الجيني للـ MTHFR (فرط الهوموسستئينية وخطورة الخثار)
. التنميط الجيني للـ PAI-1
4G/5G (خطورة احتشاء العضلة القلبية)
الفيتامين B6 عوز فيتامين B6K فرط الهوموسستيئينية
Vitamin B6 Vitamin B6 Deficiency Hyperhomocysteinaemia
 يشمل مصطلح فيتامين
B6
ثلاثة مشتقات بيريدينية طبيعية هي: البيردوكسين، البيردوكسامين
والبيردوكسال(PL)
إضافة لاستراتها الفسفاتية: بيردوكسين – 5َ - فسفات، بيردوكسامين-5َ-فسفات
والبيردوكسال-5َ-فسفات(PLP)
.
يشمل مصطلح فيتامين
B6
ثلاثة مشتقات بيريدينية طبيعية هي: البيردوكسين، البيردوكسامين
والبيردوكسال(PL)
إضافة لاستراتها الفسفاتية: بيردوكسين – 5َ - فسفات، بيردوكسامين-5َ-فسفات
والبيردوكسال-5َ-فسفات(PLP)
.
ومن بينها جميعاً يعتبر البيردوكسال-5َ-فسفات(PLP) هو التميم الأنظيمي
الفعالactive coenzyme، وبالتالي يمكننا الاكتفاء بقياس الـ PLP هذا
لتقييم حالة الفيتامين B6.
الـ PLP يلعب دور تميم العامل cofactor في تفاعلات أنظيمية عديدة، كما
هو عليه الحال في اصطناع السيروتونين والنيكوتيناميد بدءاً من
التريبتوفان. ونظراً لأهميته في استقلاب الحمض الأميني، فإن عوز
الفيتامين B6 يؤدي لزيادة اطراح مستقلبات الحمض الأميني amino acid
metabolites.
 تشتمل
الأعراض على فرط تصبغ الجلد إضافة للاكتئاب والتهيج. ونظراً للدور
المباشر الذي يلعبه الفيتامين B6 في تحول الحمض الأميني عالي السمية،
الهوموسستئين، إلى سستئين، فإن عوز فيتامين B6 يؤدي لارتفاع تركيز
الهوموسستئين وبالتالي إلى زيادة ملحوظة في خطورة الإصابة بالتصلب
العصيدي atherosclerosis
تشتمل
الأعراض على فرط تصبغ الجلد إضافة للاكتئاب والتهيج. ونظراً للدور
المباشر الذي يلعبه الفيتامين B6 في تحول الحمض الأميني عالي السمية،
الهوموسستئين، إلى سستئين، فإن عوز فيتامين B6 يؤدي لارتفاع تركيز
الهوموسستئين وبالتالي إلى زيادة ملحوظة في خطورة الإصابة بالتصلب
العصيدي atherosclerosis
الهوموسستئين
احتشاء العضلة القلبية، الخثار، السكتة والخرف
![]()


الهوموسستئين هو
عامل خطورة مستقل للإصابة بالأمراض الوعائية
تعزى معظم الوفيات في البلدان الصناعية للأمراض القلبية
الوعائية والتصلب العصيدي. ورغم ذلك فإن عوامل الخطورة المتعارف عليها
كارتفاع مستويات الكولسترول في الدم، فرط التوتر الشرياني، السكري
والتدخين ليست مسؤولة إلا عن قرابة 50% من الحالات.
وحالياً يُعرف الهوموسستئين (Hcy)كعامل خطورة مستقل للإصابة بالتصلب
العصيدي، الأمراض الوعائية المحيطية، أمراض القلب الاكليلية والسكتة
(3)،(2)،(1).
وأكثر من ذلك، فالمستويات المرتفعة من الهوموسستئين قد تعزز من خطورة
الإصابة بالخثار الوريدي حتى عشرة أضعاف.
ومن هنا، فإن تقييم مستويات الـ Hcy والعوامل المرتبطة به يعتبر على
درجة قصوى من الأهمية.
البنية التركيبية للهوموسستئين والمركبات
المرتبطة به والتي تتواجد في البلازما البشرية
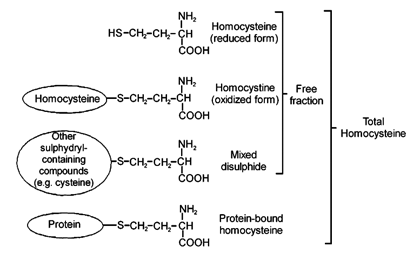
(Ann Clin Biochem 1999; 36: 372-9)
التأثيرات
الوعائية المفترضة للهوموسستئين
وتتضمن الأذية التأكسدية للخلايا البطانية الوعائية وكذلك حث
زيادة تكاثر الخلايا العضلية الملساء الوعائية عقب الاستقلاب التأكسدي
للـ Hcy إلى هوموسستين وهوموسستئين ثيولاكتون. هذا ويعزز التعديل
التأكسدي للبروتين الشحمي خفيض الكثافة LDL تشكل خلايا رغوية foam
cells ، توفر بدورها مصدراً آخر لأنماط من الأوكسجين المنشط(8) reactive
oxygen
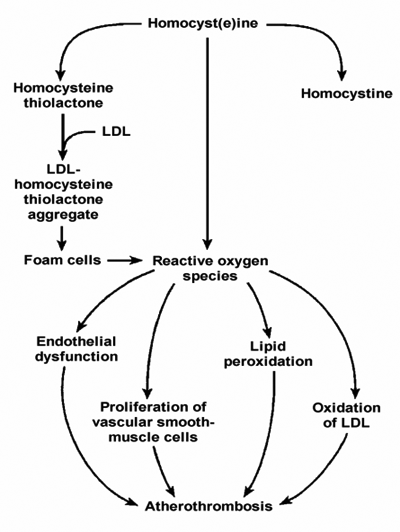
التأثيرات الوعائية المفترضة للهوموسستئين
Postulated Adverse Vascular Effects of Homocyst(e)ine
(N Engl J Med 1998, 338(15):1042-50)
الهوموسستئين
واحتشاء العضلة القلبية
![]()
أشارت دراسات عديدة إلى وجود علاقة مابين مستويات الـ Hcy
البلازمية وحدوث احتشاء العضلة القلبية، مع تراجع معدلات البقاء عقب
الإحتشاء(11)،(10)،(9).
الهوموسستئين
وخطورة السكتة
تبين في إحدى الدراسات البريطانية التي ركزت على العلاقة ما بين
تركيز الـHcy والسكتة لدى ذكور متوسطي الأعمار، بأن تراكيز
الهوموسستئين الكلية كانت أعلى وبشكل ملحوظ لدى المصابين مقارنة
بمجموعات المراقبة وبأن الخطورة النسبية للسكتة تزايدت بازدياد مستويات
الـ Hcy.
وهذا إن دل على شيء فإنما يدل على أن الهوموسستئين الكلي هو عامل خطورة
قوي ومستقل للإصابة بالسكتة (12).
الهوموسستئين
البلازمي كعامل خطورة للإصابة بالخرف وبداء آلزهايمر
في دراسة متابعة شملت 1092 شخص على مدى ثماني سنوات تبين إصابة
111 منهم بالخرف dementia، وقد شُخصت 83 حالة من بينها على أنها داء
آلزهايمر.
ووفقاً لهذه الدراسة، تبين بأن ارتفاع مستويات الـHcy بمقدار انحراف
معياري واحد (SD) يزيد من خطورة الإصابة بالخرف بمعدل 1.4، ومن خطورة
داء آلزهايمر بمعدل 1.7 (13).
أسباب ارتفاع
الهوموسستئين
تشمل أسباب ارتفاع الـHcy مايلي:
- عدم كفاية كلوية
- عوز الفيتامينات ( (B12, B6, Folate
- عوز 5،10-ميتلين تتراهيدرو فولات-ريدكتاز
- عوز السيستاثيونين-β سنتتاز(صفة صبغية جسدية متنحية)
نظرة على عوامل
الخطورة المرتبطة بالهوموسستئين
يعاني قرابة 50% من المجموعات العمرية التي تتجاوز50 عاماً من
زيادة في مستويات الهوموسستئين، حيث تتبدى الزيادة لدى الذكور بالخاصة
مقارنة مع الإناث.
إن مستويات الـHcy التي تتجاوز 9 ميكرومول/ل تتزامن مع خطورة متزايدة
لاحتشاء العضلة القلبية، السكتة والخرف، أما المستويات التي تفوق 20
ميكرومول/ل فهي تعكس خطورة متزايدة للإصابة بالخثار.
هذا ويمكن تعديل مستويات الـHcy غالباً عن طريق تناول فيتامينات فموية
معاوضة كالفولات، فيتامين B6وفيتامين B12 (14)، وذلك باستثناء حالتي
اليوريمية والتهاب المعدة الضموري ( حيث يحتاج هذا الأخير إلى معالجة
بديلة بزرق فيتامين B12).
|
لابد من استبعاد عوز فيتامين B12 قبل إعطاء الفولات، كي لانعزز الأعراض العصبية الغير مرغوبة! |
طفرات جين MTHFR
إن ارتفاع مستويات الـ Hcyرغم وجود مستويات طبيعية من الفيتامين
قد يعزى إلى وجود طفرة في جين الميتلين-تتراهيدروفولات-ريدكتاز، الأمر
الذي يؤدي إلى فعالية متناقصة لهذا الأنظيم الأساسي.
إن اختبار طفرات جين الـMTHFR الذي نزودكم به يستبعد التأهب الوراثي
لفرط الهوموسستيئينية.
مزايا خفض
الهوموسستئين لدى مرضى الإصابات القلبية الوعائية
من المسلم به حاليا بأنه يمكننا خفض مستويات الهوموسستئين البلازمية
بشكل ملحوظ عبر تناول مستحضرات فيتامينية فموية، أي بإعطاء حمض الورق
وفيتاميني
B6
و B12 (العلاج بالفولات).
وفي حين أوضحت الدراسات المجراة لدى الحيوانات بأن مستويات
الهوموسستئين ترتبط بخطورة عود التضيق restenosis
عقب رأب السباتي (6) (5) carotid angioplasty
فإن المعلومات المتعلقة بالبشر كانت متضاربة.
في أحد الدراسات، أظهر Schnyder
وزملاؤه (15) بأن العلاج بالفولات أدى إلى تراجع يذكر بمعدلات عود
التضيق (من 37,6% لدى مجموعة المراقبة إلى 19,6% لدى مجموعة العلاج
بالفولات)، كذلك الحال بالنسبة لضرورة إعادة توعية الآفة
revascularization tagetlesion (من 22,3%
إلى 10,8%)
هذا وقد وجد Lang وزملاؤه (16)
بأن المعالجة بالفولات ذات تأثير معاكس على خطورة عود التضيق بين
المرضى الذين تلقوا إستنت اكليلي coronay
stent وذلك رغم قدرته على خفض
مستويات الهوموسستئين البلازمية بشكل عميق وواضح.
ومهما يكن من أمر، يبدو بأن المعلومات التي قدمها Schnyder
وزملائه (15) تنطبق على المرضى الذين عولجوا بطريقة الرأب بالبالون
ballon angioplasty
فحسب، أما بالنسبة للمرضى الذين تلقوا استنت اكليلي، فإن المعالجة
بالفولات قد لا ينصح بها في حالتهم.
قراءات مختارة
| [1] |
Nygard,O. et al.:
Plasma homocysteine levels and mortality in patients with coronary artery disease N Engl J Med 1997, 337(4):230-236 |
|
| [2] |
Tsai,JC et al.:
Promotion of vascular smooth muscle cell growth by homocysteine: a link to atherosclerosis
PNAS 1994, 91(14):6369-6373 |
|
| [3] |
Bostom,Andrew G. et al.:
Nonfasting Plasma Total Homocysteine Levels and Stroke Incidence in Elderly Persons:
The Framingham Study Ann Intern Med 1999, 131(5):352-355 |
|
| [4] |
Mandel,H. et al.:
Coexistence Of Hereditary Homocystinuria And Factor V Leiden - Effect On Thrombosis N Engl J Med 1996, 334(12):763-768 |
|
| [5] |
den Heijer,M. et al.:
Hyperhomocysteinemia as a Risk Factor For Deep-Vein Thrombosis N Engl J Med 1996, 334(12):759-762 |
|
| [6] |
Cattaneo,M. et al.:
Low Plasma Levels of Vitamin B6 Are Independently Associated With a Heightened
Risk of Deep-Vein Thrombosis Circulation 2001, 104:2442-2446 |
|
| [7] |
Welch,G.; Loscalzo,J.:
Homocysteine And Atherothrombosis N Engl J Med 1998; 338(15):1042-1050 |
|
| [8] |
Eikelboom,John W. et al.:
Homocyst(e)ine and Cardiovascular Disease; A Critical Review of the Epidemiologic Evidence
Ann Intern Med 1999; 131:363-375 |
|
| [9] |
Liaugaudas,G. et al.:
Renal insufficiency, vitamin B(12) status, and population attributable risk for mild
hyperhomocysteinemia among coronary artery disease patients in the era of folic
acid-fortified cereal grain flour. Arterioscler Thromb Vasc Biol 2001; 21(5):849-51 |
|
| [10] |
Perry,IJ et al.:
Prospective study of serum total homocysteine concentration and risk of stroke in
middle-aged British men
Lancet 1995; 346:1395-1398 |
|
| [11] |
Seshadri,S. et al.:
Plasma homocysteine as a risk factor for dementia and Alzheimer's disease N Engl J Med 2002; 346(7):476-483 |
|
| [12] |
Jacques,Paul F. et al.:
The Effect of Folic Acid Fortification on Plasma Folate And Total Homocysteine Concentrations
N Engl J Med 1999, 340(19):1449-1454 |
|
| [13] |
Schnyder,G.et al.:
Decreased rate of coronary restenosis after lowering of plasma homocysteine levels N Engl J Med 2001, 345(22):1593-1600 |
|
| [14] |
Lange,H. et al.:
Folate Therapy and In-Stent Restenosis after Coronary Stenting N Engl J Med 2004, 350(26):2673-2681 |