OMIM
إن (Online Mandelian Inheritance in Man=OMIM (http://www.ncbi.nih.gov/omim)
عبارة عن قائمة بيانات تتعلق بالمورثات البشرية والاضطرابات
الوراثية مؤلفة ومنشورة من قبل Dr. Victor A. McKusick وزملائه
في جامعة Johns Hopkins (بالتيمور، ميريلاند، الولايات المتحدة
الأميركية).
وكل قسم يحتوي على مجموعة كاملة من المعلومات متضمنة التوضيحات
السريرية والأعراض، الزيغ الوراثي genetic aberrations،
الانذار و الخيارات العلاجية.
تتضمن جميع الفقرات المتعلقة باضطراب وراثي ما الرقم المرجعي
الخاص بالـ OMIM والذي يسمح بالحصول على معلومات تفصيلية من
شبكة الـ OMIM.
التصلب
العصيدي، الأمراض الوعائية: الخثار، احتشاء العضلة القلبية
.
التنميط الجيني
للـ ِApoE (خطورة التصلب العصيدي)
.
التنميط الجيني للـ MTHFR (فرط الهوموسستئينية وخطورة الخثار)
.
خطورة الانصمام الخثاري (النمط الجيني للميل الخثاري الوراثي)
.
التنميط الجيني للـ PAI-1 4G/5G (خطورة احتشاء العضلة القلبية)
النمط الجيني للصميم E
كواسم بديل في فرط بروتينات الدم
الشحمية، مرض القلب الاكليلي،
المرض الوعائي الشرياني والوريدي وفي الاضطرابات العصبية
الـ ApoE هو معلم رئيسي في اضطرابات
الاستقلاب الشحمي والخرف Dementia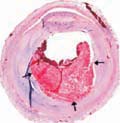
إن صميم البروتين الشحمي
Apolipoprotein هو بروتين سكري يلعب دوراً أساسياً في استقلاب
الشحوم. يتكون الـ ApoE من بروتينات شحمية خفيضة الكثافة (
بقايا دقائق كيلوسية ، IDL ,VLDL , chylomicron remnants
) تتم
إزالتها من الدوران عبر الالتقام الخلوي endocytosis عن طريق
المستقبلات الكبدية.
هذا وتعزى تغيرات الكولسترول للـ ApoE أكثر من أن ترتبط بأي
جين معروف آخر. وبناء على ذلك, فإن لتبدلات الـ ApoE تأثير قوي
على الأمراض المتعلقة بالشحوم كالتصلب العصيدي، الأمراض
القلبية الوعائية، السكتة أو الاعتلال الكلوي السكري المرافق
للبروتين الشحمي lipoprotein-associated diabetic nephropathy.
يقوم الـ ApoE بالإضافة لدوره في استقلاب الشحوم بوظائف عديدة
أخرى: تعديل الاستجابة المناعية الخلوية، تثبيط تكدس الصفيحات
وتنظيم الاصطناع الستروئيدي.
أما في الجملة العصبية المحيطية فإن الـ ApoE يؤثر على نمو
وتمايز العصبوناتneurones .وكنتيجة لذلك ولتحطيم الببتيدات
النشوانية amyloid peptides المخربة للأعصاب ولمركبات اللويحة
plaque compounds فإن الـ ApoE يلعب دوراً في إمراضية داء
الزهايمر AD) Alzheimer Disease)
يتواجد الـ
ApoE ِ بثلاثة نظائر متعددة الأشكال
يتواجد جين الـ ApoE الذي يقع على الصبغي رقم 19 وفقاً
لثلاثة ألائل شائعة متعددة الأشكال: e2 ,e3 ,e4 والتي تشفر
للنظائر E2, E3, E4. وتبعاً للتركيبة combination نحصل على ست
أنماط جينية مختلفة.
تنوعات الـ
ApoE تلعب دوراً مهماً في تحديد المرض الوعائي
إن الخلل في تصفية الدقائق الكيلوسية وبقايا VLDL
المترتب على عيب في صميم البروتين الشحمي E يؤدي إلى تزايد
تراكيز الكولسترول والشحوم الثلاثية في البلازما الأمر الذي
يمكن أن يتسبب في إصابة وعائية محيطية و/أو اكليلية مبكرة.
الـ ApoE2 لا يرتبط بمستقبل الـ LDL مما يؤدي لتزايد تركيز
الكولسترول في الدم (فرط الكولستروليمية) وهذا بدوره يعزز
خطورة المرض القلبي الوعائي.
يعاني حملة الالليل e4 من انخفاض التركيز الدموي للـ ApoE،
الأمر الذي يتزامن مع تزايد احتمال حدوث التصلب العصيدي نظراً
لتراجع تصفية الكولسترول من الدم.
نظائر
ApoE توفر واسم بديل في الأمراض العصبونية
يؤثر النمط الجيني ApoE e4 علىالإصابة العصبونية
neuronal disease عموماً عبر التبدلات التي تطرأ على فعالية
صيانة العصبونات واصلاحها.
وهكذا يعتبر التنميط الجيني للـ ApoE واسماً هاماً في
الاضطرابات العصبية كالخرف، داء الزهايمر والتصلب
المتعدد multiple sclerosis .
النمط
الجيني للـ ApoE واسم إنذاري هام في داء التصلب المتعدد
يعاني المرضى من حملة الالليل ApoE e4 من ترقي سريع
وملحوظ للإعاقة (1) مع معدل تزايد سنوي يصل إلى خمسة أضعاف في
ضياع الكتلة الحجمية للدماغ مقارنة بالمرضى الذين لا يحملون
الالليل .
وعلى العكس من ذلك فالـ ApoE e2 يتزامن مع وطأة مرضية أخف
إضافة لتراجع سنوي محدود للكتلة الدماغية (3).
الدليل
ApoE4 هو عامل خطورة للإصابة بداء الزهايمر
وجد بأن الليل ApoE e4 يتزامن مع ظهور متأخر للأنماط
العائلية familial والفرادية sporadic من داء الزهايمر (4)
هذا وتتزايد خطورة الإصابة بالـ AD من 20 إلى 90% ويتراجع
متوسط العمر لظهور المرض من 84 إلى 68 سنة مع تزايد عدد ألائل
الـ ApoE e4. وقد لوحظ بأن تماثل الزيجوت للـ e4كان كاف عملياً
للإصابة بالـ AD في عمر الثمانين (5).
إن السبب الحقيقي وراء ذلك لا يزال مجهولا،ً ولكن اتضح بأن للـ
ApoE4 ألفة عالية تجاه البيتا اميلويد β-amyloid, والذي يعتبر
المكون الرئيسي لللويحات الشيخوخية senile plaques لداء
الزهايمر (6).
ولما كان داء الزهايمر مرض متعدد الأسباب والعوامل، فإن الـ
ApoE4 لايعتبر المسؤول الوحيد عن هذه الإصابة، ولكنه عامل
مؤازر co - factorعلى درجة كبيرة من الأهمية.
وخلاصة القول، فالتنميط الجيني للـ ApoE يوفر لنا معلومات هامة
تساعد على تقييم المرضى المشتبه بإصابتهم بالـ AD وعلى تحديد
احتمال وجود عامل خطورة مألوف.
استطباب
التنميط الجيني للـ ApoE
ـ تشخيص فرط بروتينات الدم الشحمية من النمط III
ـ الاضطرابات الاستقلابية الشحمية مع ارتفاع الـVLDL
ـ توضيح مدى فعالية الحمية منخفضة الشحوم
ـ تفسير سبب البداية المبكرة للمرض القلبي الوعائي
ـ تفسير سبب الإصابة المحتملة بالخرف (مرض الزهايمر Morbus
Alzheimer)
ـ تقييم الإنذار في مرض التصلب المتعدد
مسببات
أخرى محتملة للأمراض الوعائية الشريانية والوريدية
ـ العامل الخامس (لايدن)
ـ العامل الثاني (البروترمبين) (G20210A)
ـ طفرات MTHFR
ـ النمط الجيني لمثبط مفعل مولد البلازمين Plasminogen
Activator Inhibitor - 1
(PAI-1)(-675, 4G/5G)
المراجع
|
[1] |
Chapman,J. et al.:
The effects of APOE genotype on age at onset and progression of neurodegenerative diseases
Neurology 2001, 57: 1482-1485
|
|
[2] |
Enzinger,C. et al.:
Accelerated evolution of brain atrophy and "black holes" in MS patients with APOE-epsilon 4
Ann. Neurol. 2004, 55: 563-569
|
|
[3] |
Kantarci,O. et al.:
Association of APOE polymorphisms with disease severity in MS is limited to women
Neurology 2004, 62: 811-814
|
|
[4] |
Poirier,J. et al.:
Apolipoprotein E polymorphism and Alzheimer's disease
Lancet 1993, 342: 697-699
|
|
[5] |
Corder,EH et al.:
Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer's disease in late onset families
Science 1993, 261: 921-923
|
|
[6] |
Polvikoski,T. et al.:
Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein
New Eng. J. Med. 1995, 333: 1242-1247
|
|
|
Cheng,D. et al.:
Functional interaction between APOE4 and LDL receptor isoforms in Alzheimer's disease
J Med Genet 2005, 42: 129-131
Spronk,H. et al.:
Blood coagulation and the risk of atherothrombosis: a complex relationship
Thrombosis Journal 2004, 2(12): doi:10.1186/1477-9560-2-12
|
الـ MTHFR: عامل خطورة للإصابة
بكل من فرط
الهوموسستيئينية،
الانصمام
الخثاري، أمراض القلب الإكليلية، عيوب الأنبوب العصبي
إن 5، 10- ميتلين تتراهيدروفولات
ريدكتاز (MTHFR) هو الأنظيم الأساسي في الطريق الاستقلابي
للهوموسستئين. وبالتالي فإن تراجع فعالية الـ MTHFR يؤدي إلى
ارتفاع التراكيز البلازمية للهوموسستئين، وهو ما يعرف بفرط
الهوموسستيئينية (1).

يعتبر فرط الهوموسستيئينية عامل خطورة معروف في الأمراض المخية
الوعائية (cerebrovascular) الوعائية المحيطية (peripheral
vrascular) و أمراض القلب الإكليلية (CHD). وأكثر من ذلك فهو يعزز
من خطورة الخثار الوريدي venous thrombosis بنسبة تصل إلى عشرة
أضعاف (2)،(3).
هذا وتزداد الإصابة بالانصمام الخثاري الوريدي بشكل واضح لدى
المرضى الذين يعانون من فرط هوموسستيئينية مشارك لطفرة في
العامل الخامس (لايدن) وذلك بالمقارنة مع نظرائهم الذين يعانون
من أحد هذين الشذوذين على حدة (2)،(4)،(5).
كذلك فإن الأفراد المصابين بفرط هوموسستئينية متزامن مع طفرة
C677T أو A1298C يكونون عرضة للإصابة باضطرابات خثارية شريانية
متنوعة بما فيها الإحتشاء العضلي القلبي والسكتة (6)،(7).
كما يعتقد بأن فرط الهوموسستيئينية خلال فترة الحمل يسهم في
ظهور عيوب الأنبوب العصبي و السنسنة المشقوقة Spina bifida
(8)،(11).
تأثير
طفرات الـ MTHFR: A1298C و C677T
يعاني الأشخاص المصابين بطفرة MTHFR من نوع C667T
بنمطيها متغاير الزيجوت (الليل طافر وآخر سوي) أو متماثل
الزيجوت (الليلين طافرين) من خطورة متزايدة للإصابة بأمراض
وعائية اكليلية.
كذلك يكون الأشخاص متماثلي الزيجوت عرضة للإصابة بالخثار
الوريدي والشرياني.
هذا وتزداد خطورة خثار الوريد العميق deep vein thrombosisلدى
الأفراد الذين يعانون من طفرة MTHFR C667T متزامنة مع طفرة في
العامل الخامس (لايدن) مقارنة بهؤلاء المصابين بأحد هاتين
الطفرتين فحسب (2)،(4)،(5).
كذلك يبدو بأن تماثل الزيجوت بالنسبة للالليل الطافر C667T
يترافق مع اعتلال عصبي بصري اقفاري أمامي لاشرياني
,nonarteritic anterior ischemic optic neuropathy الأمر الذي
شوهد بتواتر أكثر ارتفاعاً لدى الأمهات اللواتي وضعن أطفالاً
مصابين بعيوب في الأنبوب العصبي (NTD).
هذا وتتزايد خطورة الإصابة بعيوب الأنبوب العصبي عندما يكون كل
من الأم والطفل حاملاً لطفرة C667T بشكلها متماثل الزيجوت.
وقد تبين بأن وجود الليل C667T طافر تزامن مع حدوث السكتة
stroke ومضاعفات جمة خلال الحمل.
ونذكر هنا حالة سريرية وثيقة الصلة بالموضوع وهي حالة المرضى
ذوي تغاير الزيجوت المركب (C677T / A1298C)، أي المرضى الذين
يحملون الليلاً طافراً و آخر سوياً في كل من الموضعين677
و,1298 على التوالي، فهم أكثر عرضة للأمراض الوعائية،
الاجهاضات العفوية وعيوب الأنبوب العصبي.
يستطب
اختبار طفراتMTHFR بنمطيها C667T و A1298C لدى المرضى:
ـ المصابين بفرط الهوموسستيئينية
ـ المصابين بمرض قلبي اكليلي
ـ الذين سبق وعانوا من احتشاء عضلي قلبي، سكتة أو خثار
ـ المصابين بطفرات العامل الخامس (لايدن) أو العامل الثاني
(G20210A)
ـ النساء الحوامل المصابات بفرط هوموسستيئينية و/أو قصة اجهاض
سابقة أو وجود طفل مصاب بعيوب الأنبوب العصبي.
وراثيات
طفرات A1298C ,
C667T MTHFR
إن استبدال السيتوزين بالتيمين في الموضع النوويدي 677
يؤدي إلى استبدال الحمض الأميني المعروف باسم فالين بالآلانين
في الرامزة 222. يترتب على ذلك التعبير عن أنظيم طافر عطوب
بالحرارة وذو فعالية أنظيمية متناقصة بمقدار 30% لدى الأفراد
متغايري الزيجوت و70% لدى الأفراد متماثلي الزيجوت، الأمر الذي
يؤدي إلى تزايد مستويات الهوموسستئين البلازمي في نهاية
المطاف.
هناك طفرة أخرى تطرأ على الـ MTHFR في الموضع النوويدي 1298
حيث يستبدل السيتوزين بالأدنين مؤدياً بذلك إلى تحول
الغلوتامات إلى الآلانين وبالتالي إلى تراجع الفعالية الأنظمية
أيضاً.
الأسباب
المحتملة الأخرى للأمراض الوعائية الشريانية والوريدية
ـ العامل الخامس (لايدن)
ـ العامل الثاني (بروترمبين) (G20210A)
ـ تعدد الأشكال للـ ApoE polymorphisms ApoE
ـ النمط الجيني لمثبط مفعل البلازمينوجين Plasminogen
Activator inhibitor- 1
(- 675, 4G/5G) (PAI-1) .
التشخيص
الجيني لطفرات MTHFR ولعوامل الخطورة الأخرى المسؤولة عن الصمة
الخثارية
بالاعتماد على أحدث طرائق الوراثة الجزيئية يمكننا
دراسة النمط الجيني لجين MTHFR في الموضعين 677 و1298 حيث ذكر
ارتباطهما بفرط الهوموسستيئينية وبتزايد خطورة الأحداث
الخثارية، أمراض القلب الاكليليلة، احتشاء العضلة القلبية أو
السكتة والتي تشاهد بتواتر أعلى لدى الأمهات اللواتي يضعن
أطفالاً مصابين بعيوب الأنبوب العصبي (NTD).
ولتقييم الخطورة الخثارية فإننا نوفر لكم دراسة الطفرة في
العامل الخامس (لايدن) والعامل الثاني (بروترمبين) (G202010A)
أيضاً. هذا وتتكامل الدراسة بتشخيص النمط الجيني للـ ApoE
والـPAI-1 (- 675, 4G/5G) . وبذلك نكون قد أحطنا بمختلف عوامل
الخطورة في الأمراض الوعائية الشريانية والوريدية.
المراجع
|
[1] |
Friso,S. et al.:
A common mutation in the 5,10-methylenetetra-hydrofolate
reductase gene affects genomic DNA methylation through an
interaction with folate status.
PNAS 2002, 99(8): 5606-5611
|
|
[2] |
Cattaneo,M. et al.:
A Common Mutation in the Methylenetetrahydro-folate
Reductase Gene (C677T) Increases the Risk for Deep-Vein
Thrombosis in Patients With Mutant Factor V (Factor V:Q506)
Arterioscler Thromb Vasc Biol. 1997;17:1662-1666
|
|
[3] |
den Heijer,M. et al.:
Hyperhomocysteinemia as a Risk Factor For Deep-Vein
Thrombosis.
N Engl J Med 1996, 334(12): 759-762
|
|
[4] |
Ridker,PM et al.:
Interrelation of Hyperhomocyst(e)inemia, Factor V
Leiden,and Risk of Future Venous Thromboembolism
Circulation 1997;95:1777-1782
|
|
[5] |
Akar,N. et al.:
Effect of methylenetetrahydrofolate reductase 677 C-T,
1298 A-C, and 1317 T-C on factor V 1691 mutation in
Turkish deep vein thrombosis patients
Thromb Res. 2000;97:163-167
|
|
[6] |
Bostom,A. et al.:
Nonfasting Plasma Total Homocysteine Levels and Stroke
Incidence in Elderly Persons: The Framingham Study.
Ann Intern Med 1999, 131(5): 352-355
|
|
[7] |
Kluijtmans,LA et al.:
Thermolabile Methylenetetrahydrofolate Reductase in
Coronary Artery Disease
Circulation. 1997;96:2573-2577
|
|
[8] |
Gos,M.; Szpecht-Potocka,A.:
Genetic basis of neural tube defects. II. Genes
correlated with folate and methionine metabolism.
J.Appl.Genet. 2002, 43(4): 511-524
|
|
[9] |
>
Kirke,PN et al.:
Impact of the MTHFR C677T polymorphism on risk of neural
tube defects: case-control study.
BMJ 2004, 328:
1535-1536
|
|
[10] |
Pietrzyk,J. et al.:
Polymorphisms of the 5,10-methylenetetrahydro-folate and
the methionine synthase reductase genes as independent
risk factors for spina bifida.
J.Appl.Genet. 2003, 44(1):111-113
|
|
[11] |
van der Put,N. et al.:
Folate, homocysteine and neural tube defects: an
overview.
Exp Biol Med 2001, 226(4): 243-270
|
قراءات مختارة
Lievers,K. et al.:
Polymorphisms in the
Transcobalamin Gene: Association with Plasma Homocysteine in Healthy Individuals and
Vascular Disease Patients.
Clinical Chemistry 2002, 48(9): 1383-1389
|
عوامل
الخطورة للإصابة بالصمة الخُثارية
العامل الخامس (لايدن),
العامل الثاني (G20210A) والـ MTHFR
عوامل الخطورة للإصابة بالانصمام
الخثاري

إن طفرة العامل الخامس V (لايدن), طفرة العامل الثاني
G20210A (بروترمبين) وتعدد أشكال polymorphism جين الـ MTHFR
(ميتلين تتراهيدروفولات ريدكتاز) تشكل عوامل الخطورة الوراثية
الأكثر أهمية في حوادث الانصمام الخثاري (1).
العامل
الخامس (لايدن)
من بين جميع عوامل الخطورة الوراثية المعروفة حالياً،
يحظى العامل الخامس (لايدن) بالانتشار الأوسع (5% من مجموع
السكان الأسوياء) (2).
يدخل العامل الخامس في شلال التخثر ويتم تثبيطه فيزيولوجياً
بواسطة بروتين C المفعل (APC). ونتيجة للطفرة النقطية التي
تطرأ في موقع الحمض النووي G1691A فإن العامل الخامس لا يُثبط
بالشكل المعتاد والكافي من قبل الـ APC ، الأمر الذي يؤدي
لترجيح توازن الإرقاء باتجاه كفة التفاعلات المعززة للتخثر.
تزداد خطورة الخثار الوريدي لدى الحملة متغايري الزيجوت (ممن
لديهم الليل طافر والليل سوي) بمقدار 5 ـ 10 أضعاف، في حين تصل
لدى متماثلي الزيجوت (ممن لديهم الليلين طافرين) إلى 50 ـ 100 ضعف (2)،(6).
العامل
الثاني (البروترمبين)
البروترومبين هو الطليعة اللامنشطة للسيرين بروتياز
ترومبين serine protease thrombin وهو يقوض المرحلة الأخيرة من
شلال التخثر، أي مرحلة تحول مولد الفبرين إلى فبرين.
تؤدي الطفرة G20210A التي تطرأ على النهاية َ3 - اللامترجمة من
جين البروترمبين إلى زيادة تركيز بروترمبين البلازما وبالتالي
إلى زيادة الميل لحدوث التخثر.
إن تعدد أشكال البروترمبين ما هو إلا طفرة وراثية تتزامن مع كل
من الخثار الوريدي والشرياني على حد سواء. هذا وتتزايد خطورة
الخثار إلى ثلاثة أضعاف تقريبا لدى الحملة متغايري الزيجوت، في
حين يندر وجود حالات متماثلة الزيجوت.
ومن الأهمية بمكان التنبه إلى أن 15 ـ 40% من مرضى الخثار
الذين يعانون من طفرة متغايرة الزيجوت في العامل الخامس
(لايدن) هم أيضاً متغايري الزيجوت بالنسبة لطفرة العامل الثاني
G20210A.
إن المشاركة ما بين هذين الخللين (تغاير زيجوت مركب) يؤدي إلى
زيادة نسبة الخطورة الخثارية لأكثر من 80%.
MTHFR
(ميتلين تتراهيدروفولات ـ ريدكتاز)
إن فرط الهوموسستيئينية حتى بشكله المعتدل يعتبر عامل
خطورة إضافي للإصابات الوعائية الوريدية و الشريانية.
الـ MTHFR هو الأنظيم الرئيسي في استقلاب الهوموسستئين.
والطفرة التي تطرأ على الموقع 677 من جين الــ MTHFR تُنتج
أنظيم عطوب بالحرارة thermolabile وذو فعالية متناقصة بما لا
يقل عن 70%. وتبعاً للتوزع السكاني فإن انتشار الحملة متغايري
الزيجوت يمكن أن يصل إلى 50%.
وتتزايد خطورة الخثار الوريدي بشكل ملحوظ لدى المرضى الذين
يعانون من طفرة إضافية في العامل الخامس (لايدن) أو
(9) العامل
الثاني G20210A
هنالك طفرة أخرى تطرأ على الموقع 1298 من جين الـ MTHFR
وتترافق أيضاً مع فعالية أنظيمية متناقصة.
ونذكر في هذا الصدد حالة مرضى تغاير الزيجوت المركب (C677T /
A1298C) أي اولئك المرضى الذين يراجعون بالليل طافر وآخر سوي
في كل من الموقعين 677 و 1298 على التوالي نظراً للخطورة
العالية لديهم للإصابة بالأمراض الوعائية، الاجهاضات التلقائية
وعيوب الأنبوب العصبي (7)،(13).
المرض
متعدد العوامل يحتاج لتحليل متعدد الأبعاد والعوامل
لما كان تغاير الزيجوت المركب لطفرات العامل الخامس
(لايدن) والعامل الثاني G20210A يبدي خطورة خثارية أعلى مما هو
عليه الأمر بحال تماثل زيجوت العامل الخامس (لايدن)، فلا بد من
طلب هذين التحليلين جنباً إلى جنب .
إن تزامن طفرات الـ MTHFR مع تغاير الزيجوت بالنسبة لطفرات
العامل الخامس أو العامل الثاني، على التوالي، يؤدي لزيادة
ملحوظة في الخطورة الخثارية. ويوصى في حالات ارتفاع
الهوموسستئين بالخاصة، بضرورة إجراء تحليل الـ MTHFR بشكل
مواز.
ولتتويج جهودنا في مجال تشخيص الأمراض الوعائية الوريدية فإننا
نزودكم بالتنميط الجيني للـ Apo E ولجين الـ PAI – 1 (مثبط
مفعل مولد البلازمين-1).
استطبابات
تشخيص الاستعداد الخثاري
ـ في حال الاشتباه بأية حادثة خثارية
ـ الخثار الراجع أو البدئي
ـ الاستعداد الخثاري العائلي
ـ المرضى المقاومين للـ APC
ـ الحوامل اللواتي سبق إصابتهن بحوادث خثارية وريدية
ـ النساء اللواتي يعانين من ضياع حمل متكرر أو من مقدمة ارتعاج
شديدة preeclampsia لامفسرة، تمزق مشيمي، تأخر النمو الجنيني
داخل الرحم، أو من إملاص stillbirth
ـ النساء اللواتي يتعاطين مانعات الحمل الفموية واللواتي سبق
وعانين من حوادث خثارية.
ـ فرط الهوموسستيئينية (تحليل MTHFR، العامل الخامس والعامل
الثاني)
|
الحالة
الخثارية |
احتمال
الخطورة النسبي |
|
طبيعية (بلا طفرة) |
1 |
|
نساء سويات يتناولن مانعات
الحمل الفموية |
4 |
|
تغاير زيجوت في العامل
الخامس |
5-7 |
|
تغاير زيجوت في العامل
الخامس مع فرط هوموسستيئينية |
20 |
|
تغاير زيجوت في العامل
الخامس مع تناول مانعات الحمل الفموية |
30-50 |
|
تماثل زيجوت في العامل
الخامس |
80 |
|
تماثل زيجوت في العامل
الخامس مع تناول مانعات الحمل الفموية |
> 100 |
|
تماثل زيجوت في العامل
الخامس مع طفرة في العامل الثاني |
> 80 |
|
معدل الخطورة النسبي للإصابة
بالخثار مقارنة بالأشخاص الطبيعيين (2)،(6) |
المراجع
|
[1] |
Simioni,P. et al.:
The Risk of Recurrent Venous Thromboembolism in Patients With an Arg 506 -->Gln
Mutation in The Gene For Factor V (Factor V LEIDEN)
N Engl J Med 1997, 336(6): 399-403
|
|
[2] |
Bertina,RM et al.:
Mutation in blood coagulation factor V associated with resistance to activated protein C
Nature 1994, 369(6475): 64-67 |
|
[3] |
Vandenbroucke,JP et al.:
Increased risk of venous thrombosis in oral-contraceptive users who are carriers
of factor V Leiden mutation
Lancet 1994, 344(8935): 1453-1457 |
|
[4] |
Rand,JH; Luong,TH:
Thrombophilias: diagnosis and treatment of thrombophilia relating to contraception
and pregnancy
Semin Hematol 1999, 36: 2-9 |
|
[5] |
Rosendaal,FR:
Venous thrombosis: a multicausal disease
Lancet 1999, 353: 1167-1173 |
|
[6] |
Bloemenkamp,KW et al.:
Enhancement by factor V Leiden mutation of risk of deep-vein thrombosis associated
with oral contraceptives containing a third-generation progestagen
Lancet 1995, 346: 1593-1596 |
|
[7] |
Ridker,PM et al.:
Factor V Leiden mutation as a risk factor for recurrent pregnancy loss
Ann Int Med 1998, 128: 1000-1003 |
|
[8] |
Kupferminc,MJ et al.:
Increased frequency of genetic thrombophilia in women with complications of pregnancy
N Engl J Med 1999, 340: 9-13 |
|
[9] |
Cattaneo,M. et al.:
A Common Mutation in the Methylenetetrahydrofolate Reductase Gene (C677T)
Increases the Risk for Deep-Vein Thrombosis in Patients With Mutant
Factor V (Factor V:Q506)
Arteriosclerosis, Thrombosis, and Vascular Biology 1997, 17: 1662-1666 |
|
[10] |
Gos,M.; Szpecht-Potocka,A.:
Genetic basis of neural tube defects. II. Genes correlated with folate and methionine
metabolism
J.Appl.Genet. 2002, 43(4): 511-524 |
|
[11] |
Kirke,PN et al.:
Impact of the MTHFR C677T polymorphism on risk of neural tube defects: case-control study
BMJ 2004, 328: 1535-1536 |
|
[12] |
Pietrzyk,J. et al.:
Polymorphisms of the 5,10-methylenetetrahydrofolate and the methionine synthase
reductase genes as independent risk factors for spina bifida
J.Appl.Genet. 2003, 44(1): 111-113 |
|
[13] |
van der Put,N. et al.:
Folate, homocysteine and neural tube defects: an overview.
Exp Biol Med 2001, 226(4): 243-270 |
قراءات مختارة
Prandoni,P. et al.:
The Clinical Course of Deep-Vein
Thrombosis. Prospective Long-Term Follow-up of 528 Symptomatic
Patients
Haematologica 1997, 82: 423-428
Martinelli,I. et al.:
Different Risks of Thrombosis in Four Coagulation Defects Associated With
Inherited Thrombophilia: A Study of 150 Families
Blood 1998, 92(7): 2353-2358
Lane,DA; Grant,PJ:
Role of hemostatic gene polymorphisms in venous and arterial thrombotic disease
Blood 2000, 95(5): 1517-1532
Spronk,H. et al.:
Blood coagulation and the risk of atherothrombosis: a complex relationship,
Thrombosis Journal 2004, 2(12): doi:10.1186/1477-9560-2-12
|
مثبط مفعل مولد البلازمين
التنميط الجيني4G/5G والأمراض
القلبية الوعائية

مثبط مفعل مولد البلازمين (PAI-1) (-675,
4G/5G)
يشكل مثبط مفعل مولد البلازمين (PAI-1) جزء من النظام الحال
للفبرين والذي يلعب دوراً حاسماً في التحكم الحيوي بتخثر الدم. فهو
يرتبط بمفعل مولد البلازمين النسجي مثبطاً بذلك تفعيل
البلازمينوجين، مما يحد من انحلال الفبرين fibrinolysis.
 كذلك فإن الـ PAI-1 يلعب دوراً هاماً في تثبيت الفبرين، إعادة
التشكل الوعائي vascular remodeling، الهجرة الخلوية، وإعادة
التشكل النسجي(2),(1) tissue remodeling.
كذلك فإن الـ PAI-1 يلعب دوراً هاماً في تثبيت الفبرين، إعادة
التشكل الوعائي vascular remodeling، الهجرة الخلوية، وإعادة
التشكل النسجي(2),(1) tissue remodeling.
وتعتبر العوامل الوراثية، الاستقلابية والأنماط المعيشية من أهم
العوامل المحددة لمستويات PAI-1 البلازمية.
تعدد أشكال الـ
PAI-1
 تهدف الاختبارات المجراة إلى التفريق
بين مايعرف النمط الجيني 4G والنمط 5G، والتي تعود للموقع 675 في
منطقة المحفز promoter من مورثة الـ PAI-1. إن ادخال/حذف زوج أساسي
واحد في هذا الموقع (تعدد أشكال 4G أو 5G في منطقة المحفز الجيني)
يؤثر على الانتساخ الجيني.
تهدف الاختبارات المجراة إلى التفريق
بين مايعرف النمط الجيني 4G والنمط 5G، والتي تعود للموقع 675 في
منطقة المحفز promoter من مورثة الـ PAI-1. إن ادخال/حذف زوج أساسي
واحد في هذا الموقع (تعدد أشكال 4G أو 5G في منطقة المحفز الجيني)
يؤثر على الانتساخ الجيني.
يترافق الالليل 4G مع انتساخ جيني متزايد، وبالتالي مع مستويات
أعلى من PAI-1، في حين يتزامن الالليل 5G "السوي" مع معدلات انتساخ
أخفض وبالتالي مع مستويات أقل منPAI-1.
النمط الجيني للـ PAI-1 هو عامل خطورة
للإصابة بالمتلازمات الاكليلية والاحتشاءات القلبية
يملك الأفراد ذوي النمط الجيني 4G/4G تراكيز مصلية للـ
PAI-1 أعلى بـ 25% من نظرائهم ذوي النمط 5G/5G. أما ذوي النمط
الجيني متغاير الزيجوت فلديهم مستويات متوسطة.
تتزامن تراكيز PAI-1 البلازمية المرتفعة مع تطور المتلازمات
الاكليلية والاحتشاءات القلبية والمرضى الذين يعانون من أمراض قلب
اكليلية ومن متماثلي الزيجوت 4G/4G لديهم خطورة أكبر للتموت القلبي
المفاجىء (5),(6) sudden cardiac death.
الرجال ذوي الالليل 4G يكونون أكثر عرضة للخثار الاكليلي (1),(2)
coronary thrombosis.
أما النساء الحوامل متماثلات الزيجوت 4G/4G فيعانين من مضاعفات
أكبر أثناء الحمل وعند الوضع مقارنة بمجموعة المراقبة، وقد يستفدن
من استعمال الهيبارين منخفض الوزن الجزيئي في مراحل الحمل المبكرة
(3)،(8)،(9).
النساء متماثلات الزيجوت من نمط 5G/5G ولديهن تنوعات في العامل
الثامن (Phe204 or Leu564) قد أبدين زيادة تصل إلى 20 ضعف للسكتة
النزفية (4) hemorrhagic stroke.
إن النمط الجيني 4G يتزامن مع تراجع معدلات البقاء عقب الجراحة
(7).
هذا وقد أشير إلى وجود علاقة ايجابية مابين مستويات الشحوم
الثلاثية، مستويات السكر، وفعالية الـ PAI-1.
مجموعات الخطورة المترافقة مع طفرة
. النساء
الحوامل
. الأفراد الخاضعون لعمليات وعائية
. الأفراد ذوي القصة العائلية لإصابة قلبية مبكرة وسكتة
. المصابين بأمراض قلبية اكليلية
طفرات
أخرى ترتبط بالأمراض القلبية الوعائية
. العامل الخامس (لايدن)
. العامل الثاني (البروترمبين)(G20210A)
. C677T MTHFR
. (112 & 158) ApoE
.
البروتين السكري IIIa PL A1/A2
. البروتين السكري Ia C807T
|
تواتر النمط
الجيني(4G/5G) لطفرة PAI-1 لدى مجموعة المراقبة من
الأسوياء |
|
PAI-1 GENOTYPE
|
% OF POPULATION |
| 4G/4G |
26 |
|
4G/5G |
50 |
|
5G/5G |
24 |
المراجع
|
[1] |
Eriksson,P. et al.:
Allele-specific increase in basal transcription of the plasminogen-activator inhibitor 1
gene is associated with myocardial infarction
PNAS 1995, 92: 1851-1855 |
|
[2] |
Lane,D.; Grant,P.: Role of hemostatic gene
polymorphisms in venous and arterial thrombotic disease
Blood 2000, 95(5): 1517-1532 |
|
[3] |
Dossenbach-Glaninger,A. et al.:
Plasminogen Activator Inhibitor 1 4G/5G Polymorphism and Coagulation Factor XIII
Val34Leu Polymorphism: Impaired Fibrinolysis and Early Pregnancy Loss
Clin Chem. 2003, 49(7): 1081-1086 |
|
[4] |
Reiner,A. et al.:
Polymorphisms of Coagulation Factor XIII Subunit A and Risk of Nonfatal Hemorrhagic
Stroke in Young White Women
Stroke 2001, 32:2580-2587 |
|
[5] |
Leander,K. et al.:
PAI-1 level and the PAI-1 4G/5G polymorphism in relation to risk of non-fatal myocardial
infarction: results from the Stockholm Heart Epidemiology Program (SHEEP)
Thromb Haemost. 2003, 89(6): 1064-1071 |
|
[6] |
Anvari,A. et al.:
PAI-1 4G/5G polymorphism and sudden cardiac death in patients with coronary artery
disease
Thromb Res. 2001, 103: 103-107 |
|
[7] |
Jones,K. et al.:
The influence of 4G/5G polymorphism in the plasminogen activator inhibitor-1 gene
promoter on the incidence, growth and operative risk of abdominal aortic aneurysm
Eur J Vasc Endovasc Surg. 2002, 23(5): 421-425 |
|
[8] |
Fabbro et al.:
Association between plasminogen activator inhibitor 1 gene polymorphisms and preeclampsia
Gynecol Obstet Invest. 2003, 56(1): 17-22 |
|
[9] |
Buchholz,T. et al.:
Polymorphisms in the ACE and PAI-1 genes are associated with recurrent spontaneous
miscarriages
Hum Reprod. 2003, 18(11): 2473-2477 |
قراءات
مختارة
Spronk,H. et al.:
Blood coagulation and the risk of atherothrombosis: a complex relationship;
Thrombosis Journal 2004, 2(12): doi:10.1186/1477-9560-2-12
Shemirani,H. et al.:
Pretreatment Plasminogen Activator Inhibitor-1 (PAI-1) Level in the Failure of Streptokinase
Therapy in Acute Myocardial Infarction;
Journal of Research in Medical Sciences 2004, 4: 22-26 |




 كذلك فإن الـ PAI-1 يلعب دوراً هاماً في تثبيت الفبرين، إعادة
التشكل الوعائي vascular remodeling، الهجرة الخلوية، وإعادة
التشكل النسجي(2),(1) tissue remodeling.
كذلك فإن الـ PAI-1 يلعب دوراً هاماً في تثبيت الفبرين، إعادة
التشكل الوعائي vascular remodeling، الهجرة الخلوية، وإعادة
التشكل النسجي(2),(1) tissue remodeling. تهدف الاختبارات المجراة إلى التفريق
بين مايعرف النمط الجيني 4G والنمط 5G، والتي تعود للموقع 675 في
منطقة المحفز promoter من مورثة الـ PAI-1. إن ادخال/حذف زوج أساسي
واحد في هذا الموقع (تعدد أشكال 4G أو 5G في منطقة المحفز الجيني)
يؤثر على الانتساخ الجيني.
تهدف الاختبارات المجراة إلى التفريق
بين مايعرف النمط الجيني 4G والنمط 5G، والتي تعود للموقع 675 في
منطقة المحفز promoter من مورثة الـ PAI-1. إن ادخال/حذف زوج أساسي
واحد في هذا الموقع (تعدد أشكال 4G أو 5G في منطقة المحفز الجيني)
يؤثر على الانتساخ الجيني.